中国科学院生态环境中心环境化学与生态毒理学国家重点实验室汪海林研究组在人工定向进化蛋白研究方面取得重要进展,相关研究成果近日在线发表于Analytical chemistry (Artificially Evolved Super Binder for Specific Recognition of N6-Methyladenine Base Modification in DNA and RNA, doi: 10.1021/acs.analchem.3c00588)。
DNA和RNA中都存在一种重要的表观遗传碱基修饰,即N6 -甲基腺嘌呤(6mA/m6A)。细菌中DNA 6mA在病原体预防、DNA复制以及错配修复中起到重要作用(Reisenauer et al. 1999, Wion et al. 2006)。2015年,在果蝇、线虫等高等生物中也发现DNA 6mA修饰(Zhang et al. 2015, Greer et al. 2015, Wu et al. 2016)。RNA m6A在RNA的转录、剪接、运输、翻译、衰减中起到作用(Liu et al. 2017, Roundtree et al. 2017, Yu et al. 2018, Wang et al. 2014, Lee et al. 2021)。目前商品化的6mA抗体能够非特异性结合不含修饰的短重复序列,产生广泛的假阳性峰(Lentini et al. 2018)。如何准确测定DNA/RNA中6mA/m6A位点及分布仍是表观遗传学领域、化学测量学与化学生物学中一个极其重要的科学难题。针对这一难题,汪海林研究团队尝试发展人工定向进化技术合成一个可高特异性、高亲和力识别N6-甲基腺嘌呤修饰的超级结合蛋白。该蛋白一旦合成成功将可应用于DNA/RNA中6mA/m6A的成像、检测和基于亲和沉淀的测序。
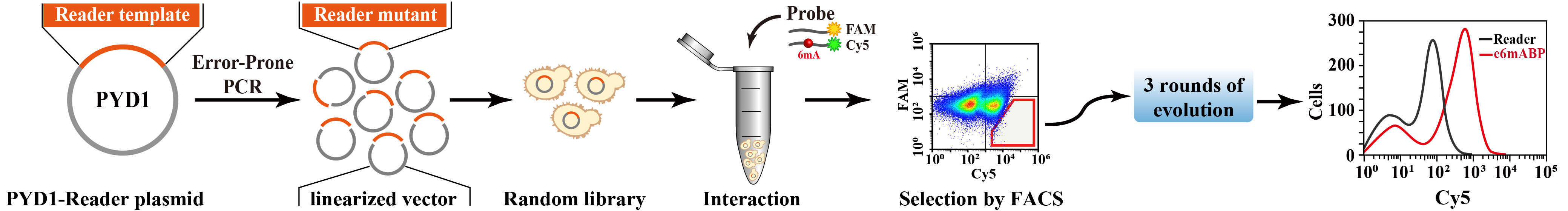
为了获得高亲和力的6mA/m6A结合蛋白,该团队首先利用易错PCR技术建立RNA m6A reader的随机突变文库,然后利用酵母表面展示相应的突变蛋白库,可获得3x108个不同的突变蛋白。采用不含6mA的DNA探针(FAM标记)作为阴性对照,含有6mA的DNA探针(Cy5标记)作为正向筛选探针,同时与酵母进行孵育。通过荧光激活细胞分选对6mA结合蛋白进行分选。采用这种进化策略,该团队进行了三次突变文库构建和筛选,获得了三种人工进化的蛋白,命名为e6mABP1、e6mABP2和e6mABP3(图1)。
图1. e6mABP蛋白的人工定向进化流程示意图。流式图中的红框门用于分选优势突变体。
分别诱导3种蛋白在酵母表面展示后进行流式表征,实验结果显示,与原始的reader模板蛋白相比,e6mABP1-3中Cy5的信号峰明显向右偏移,说明这些蛋白的Cy5结合信号增加,但是FAM结合信号相似。将这些流式图重叠,可以看出e6mABP1、e6mABP2和e6mABP3的Cy5荧光强度分别是初始reader模板的2.6倍、12.4倍和26.5倍。为了让进化的蛋白在体外与含6mA的DNA结合并验证蛋白活性,该团队纯化了重组蛋白MBP-Flag、MBP-Flag-reader、MBP-Flag-e6mABP1、MBP-Flag-e6mABP2和MBP-Flag-e6mABP3,纯度在98.7% ~ 99.3%,终浓度约为20 ~ 30 mg/mL。该团队将e6mABP蛋白与DNA探针孵育,进行了凝胶电泳迁移分析。分别观察e6mABPs-DNA复合物和未结合DNA探针的两条条带。与不含6mA的DNA探针相比,e6mABP3在100 nM的情况下就可以观察到其对含有6mA的DNA有更明显的结合倾向。e6mABP2和e6mABP3对不含6mA的DNA的亲和力(Kd)分别为1620 nM和1549 nM,与reader模板蛋白(Kd=686 nM)相比,e6mABP2和e6mABP3对不含6mA的DNA的亲和力较低。与reader模板蛋白(Kd=150 nM)相比,e6mABP2和e6mABP3对含有6mA的DNA的亲和力(Kd=54-93 nM)都有所增加。这些结果表明,e6mABPs比reader模板蛋白对含有6mA的DNA探针具有更高的亲和力和特异性。因此,随着进化轮数的增加,筛选获得的e6mABP对不含6mA的DNA探针的亲和力降低,而对含6mA的DNA探针的亲和力显著增加。
研究团队以m6A reader YTHDF2C为初始模板,进行包含突变文库构建、酵母表面展示、FACS的三轮定向进化,最终筛选获得6mA超级结合蛋白e6mABPs。e6mABPs对含有6mA的DNA具有较高的亲和力和特异性。获得的e6mABPs将为6mA富集提供一种高效、可重复且经济的方法。此外,该研究的进化方案也可以用于其它DNA/RNA修饰的特异性结合蛋白的进化与筛选,促进相关研究的发展。
中国科学院生态环境研究中心博士生刘艳为论文的第一作者,汪海林研究员为通讯作者。该研究工作得到国家自然科学基金的资助。
论文链接: https://pubs.acs.org/doi/10.1021/acs.analchem.3c00588
DOI: 10.1021/acs.analchem.3c00588
环境化学与生态毒理学国家重点实验室
2023年4月28日