随着聚苯乙烯制品在现代生活和各种产业中的广泛使用,其对环境的影响逐渐引起了研究者们的关注。微/纳米颗粒已经在各种人类组织样本中被发现,因此解析微/纳米颗粒对机体造成的毒性,以及寻找潜在的毒性作用机制至关重要。
液-液相分离(Liquid-liquid phase separation, LLPS)是介导生物大分子在细胞中时空调控的重要机制,参与多种重要生物功能调控。然而,异常相分离与神经退行性疾病密切相关, LLPS的异常相变被认为是导致胞浆形成TDP-43(TAR DNA binding protein-43, TAR DNA结合蛋白43)蛋白聚集并引发ALS的关键致病机制之一。需要特别指出的是,我们的疾病模型并不是渐冻症,不能由此推断这种纳米颗粒与渐冻症的关联。
颗粒污染物作为外源性物质导致细胞应激响应,部分颗粒不仅逃逸溶酶体降解,而且其自身性质可抵抗溶酶体强酸性,导致其成为持久性应激源。此外,颗粒污染物与LLPS驱动形成的亚细胞结构(生物分子凝聚体)之间的关系仍然是未知的。
研究发现,内化的聚苯乙烯纳米颗粒作为持久性应激源,诱发细胞氧化应激,促进ALS相关的TDP-43在相分离驱动下形成细胞核内生物分子凝聚体。然而,持久性细胞内应激导致Hsp70(Heat shock protein 70,热休克蛋白70)的伴侣保护作用受到抑制,导致液样态的TDP-43凝聚体向固样态转变,并生成TDP-43相关的病理性结构,如磷酸化TDP-43和淀粉样蛋白。
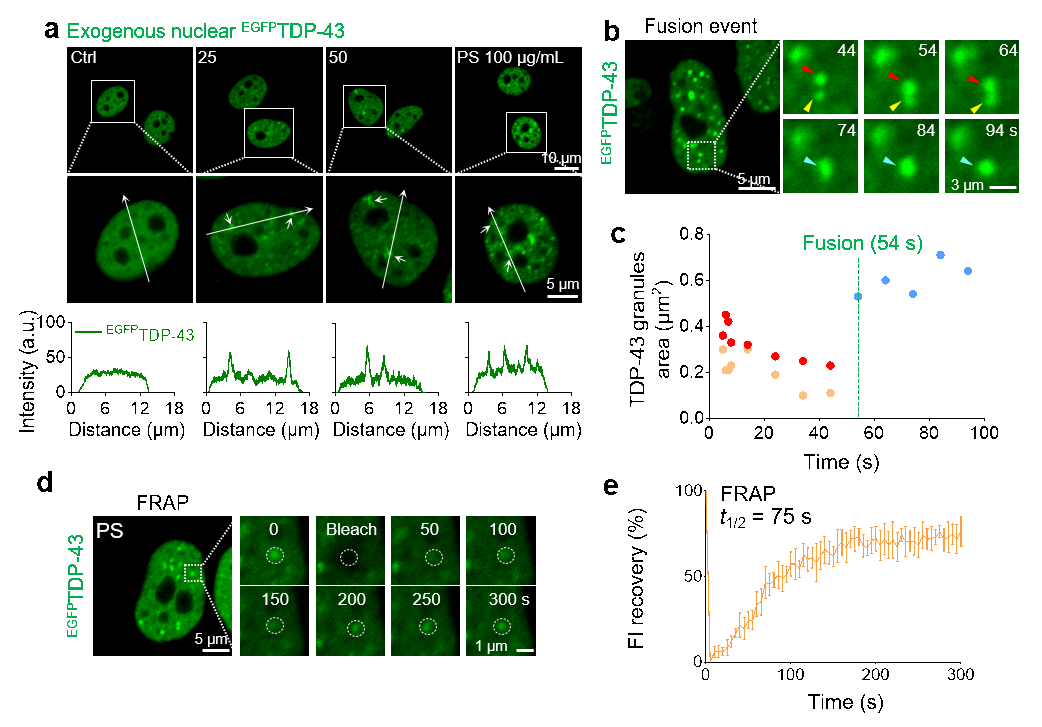
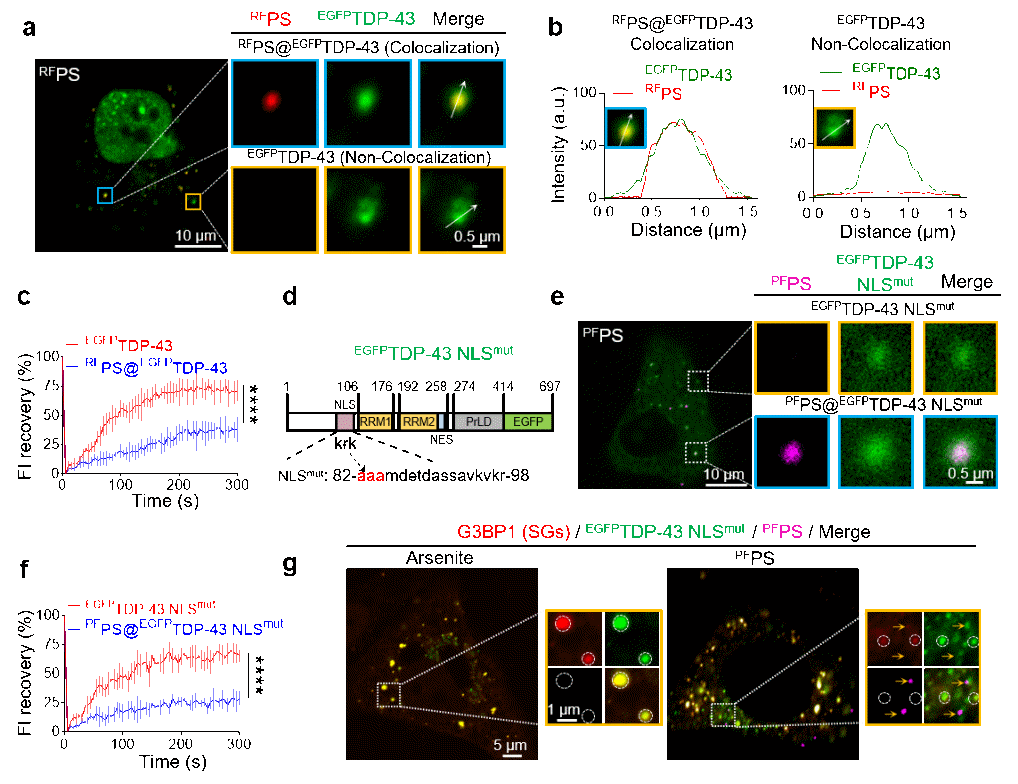
受损的Hsp70无法护送TDP-43回到细胞核以及有效的蛋白质量控制,导致TDP-43在细胞质中积聚并促进了PS和TDP-43之间形成“PS@TDP-43 complexes”,加剧细胞质TDP-43的凝结和固化。应激颗粒(Stress granules, SGs),一种多成分组装的无膜细胞器,被认为是异常定位的TDP-43的短暂“庇护所”,内部的RNA或DNA可延缓TDP-43病理化。然而,由于PS@TDP-43 complexes之间的相互作用限制了细胞质TDP-43募集至SGs,进一步促进细胞质TDP-43病理化结构形成。
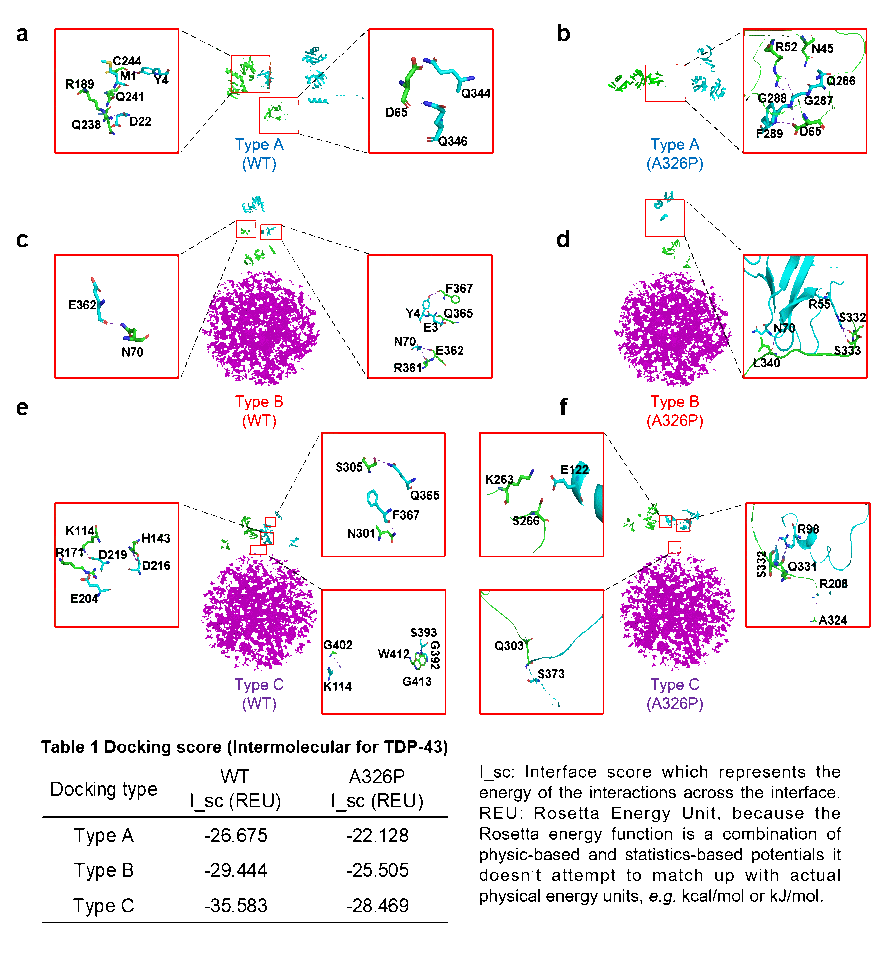
纳米颗粒吸附蛋白质通常会改变其结构特征,主要是因为纳米颗粒表面具有独特的化学和物理性质,与蛋白质之间的相互作用可能会促进蛋白质的纤维化速率。通过计算机分子对接模拟了TDP-43在PS表面的分子间相互作用,结果表明PS的存在改变了TDP-43分子间的相互作用,主要体现为TDP-43分子间亲和力提高和分子间相互作用位点增多。两分子TDP-43同时对接PS时,TDP-43分子间的相互作用更强,这可能归因于PS的对接或接触导致TDP-43在界面作用力下使结构域内的残基重新排列或暴露,从而加强分子间相互作用。
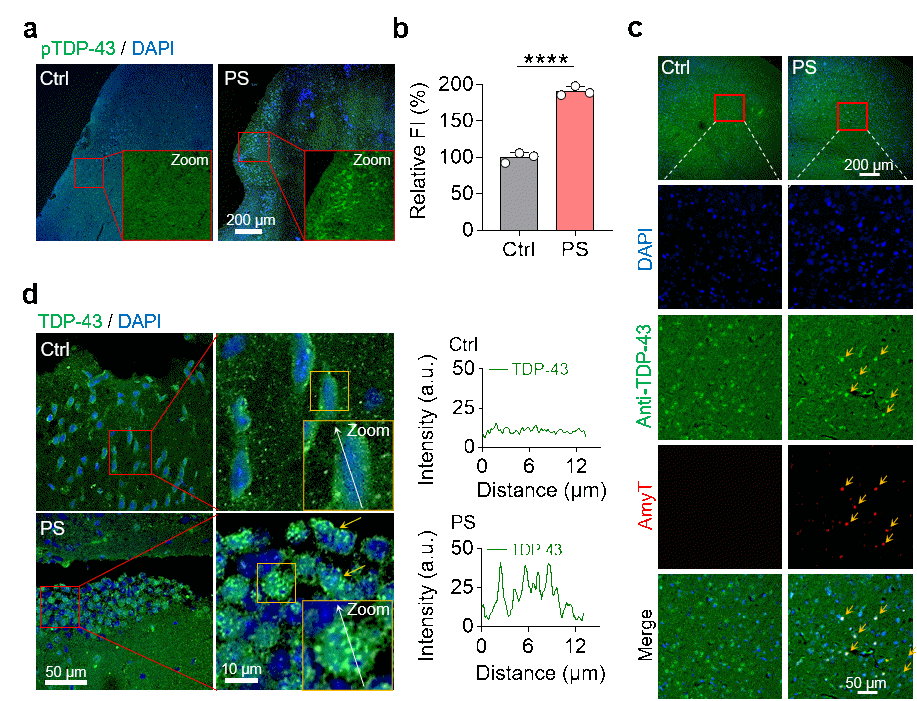
通过鼻腔滴注聚苯乙烯纳米颗粒,不仅导致小鼠运动行为学异常,还在小鼠大脑皮质层区域发现典型的ALS疾病标志物形成,如磷酸化的TPD-43和淀粉样结构。此外,在动物水平上还发现液滴样TDP-43结构生成,暗示动物水平上可能具有形成TDP-43凝聚体的可能。
总的来说,该研究阐述了纳米颗粒诱导的一种独特的毒理学机制,并为环境污染与神经退行性疾病之间的联系提供了新见解。相关研究成果发表以“Polystyrene nanoparticles trigger aberrant condensation of TDP-43 and amyotrophic lateral sclerosis-like symptoms”为题发表于Nature Nanotechnology。
论文链接:https://www.nature.com/articles/s41565-024-01683-5
环境化学与生态毒理学国家重点实验室
2024年6月8日
